2025年Q1,全國醫療器械注冊備案信息匯總統計如下:
-
注冊批準醫療器械數量6641項;
-
備案批準醫療器械數量7714項;
-
創新審批注冊醫療器械產品56項;
-
優先審批注冊醫療器械產品18項
01
注冊情況分析
據《醫療器械監督管理條例》規定,第Ⅱ、Ⅲ類醫療器械采用產品注冊管理方式。
-
境內第二類醫療器械由省、自治區、直轄市藥監局審查,批準后發給醫療器械注冊證。
-
境內第三類醫療器械由國家藥監局審查,批準后發給醫療器械注冊證。
-
進口第二類、第三類醫療器械由國家藥監局審查,批準后發給醫療器械注冊證。香港、澳門、臺灣地區醫療器械的注冊、備案,參照進口醫療器械辦理。
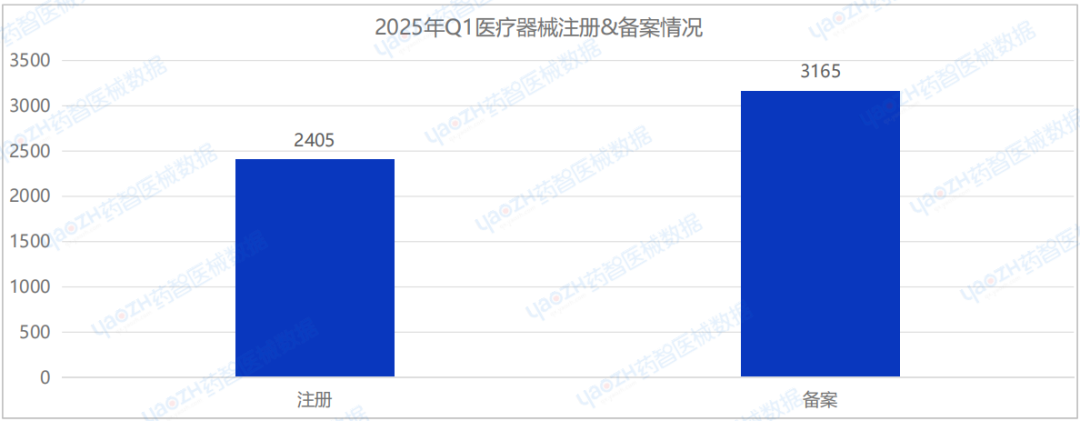
據藥智醫械數據最新統計,2025年Q1季度中,全國批準的注冊醫療器械數量環比下降11.6%;審批備案的醫療器械數量環比下降27.7%。2025年Q1醫療器械的注冊&備案情況詳見下圖。
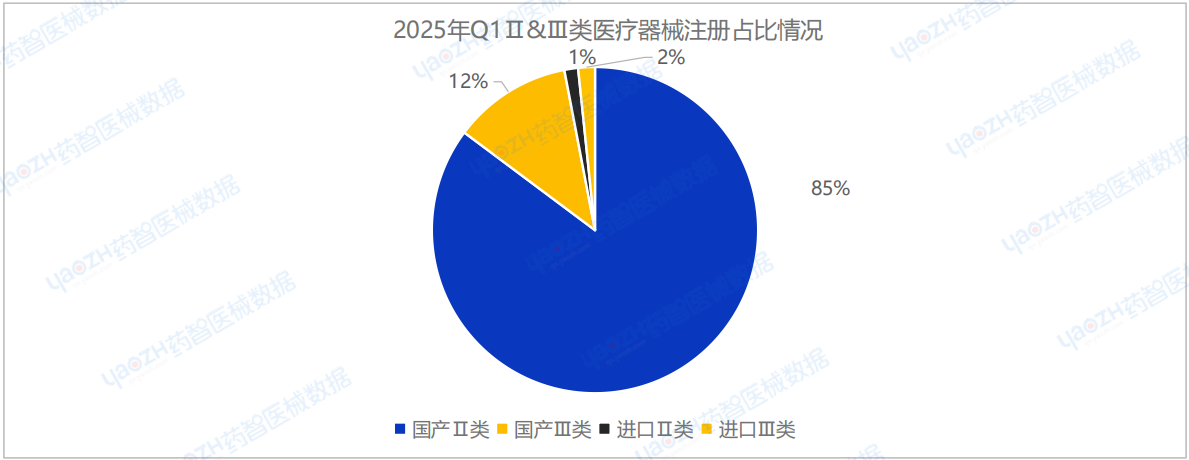
2025年Q1季度,在全國批準注冊的醫療器械產品中,國產第Ⅱ類醫療器械產品共5659項,國產第Ⅲ類醫療器械產品有782項,進口第Ⅱ類醫療器械產品90項,進口第Ⅲ類醫療器械產品110項。其中,國產器械總體占比高達96.9%。
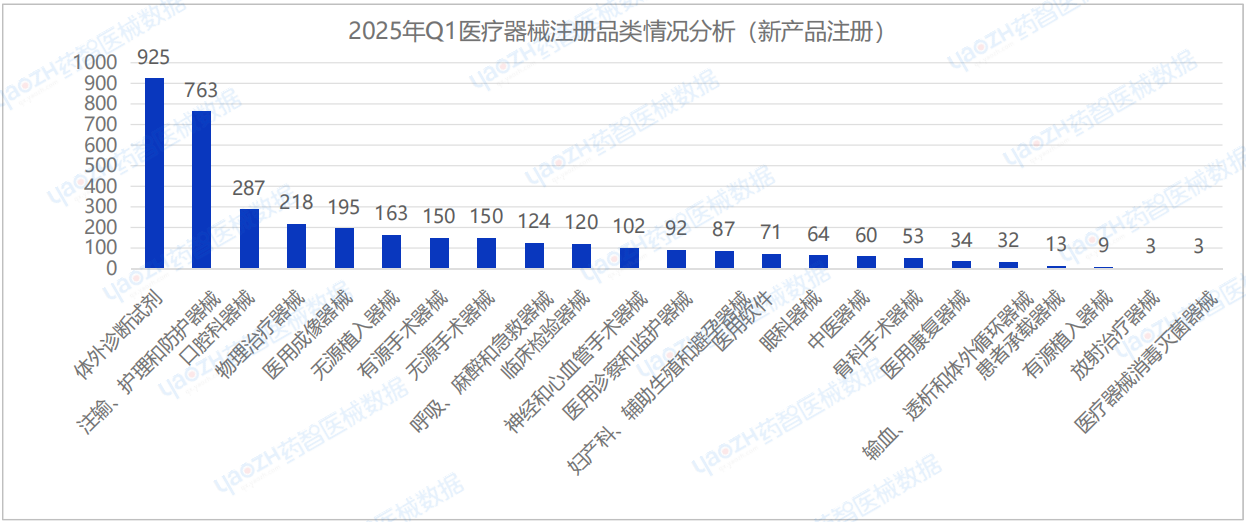
從產品類別來看,在2025年Q1季度首次注冊的醫療器械中,體外診斷試劑(925件)、注輸、護理和防護器械(763件)及口腔科器械(287件)的注冊數量排名前三。
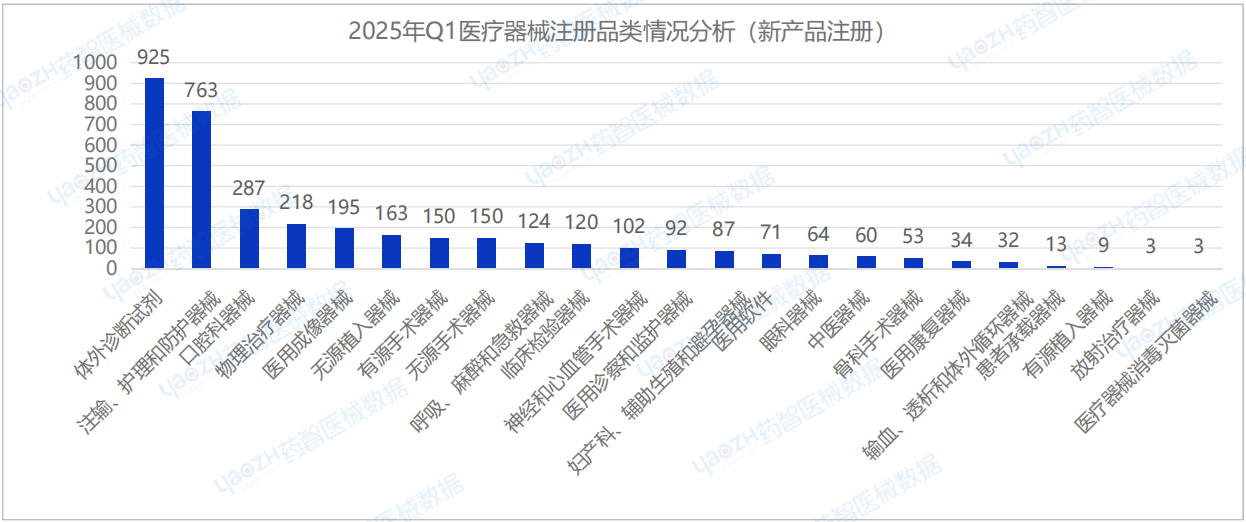
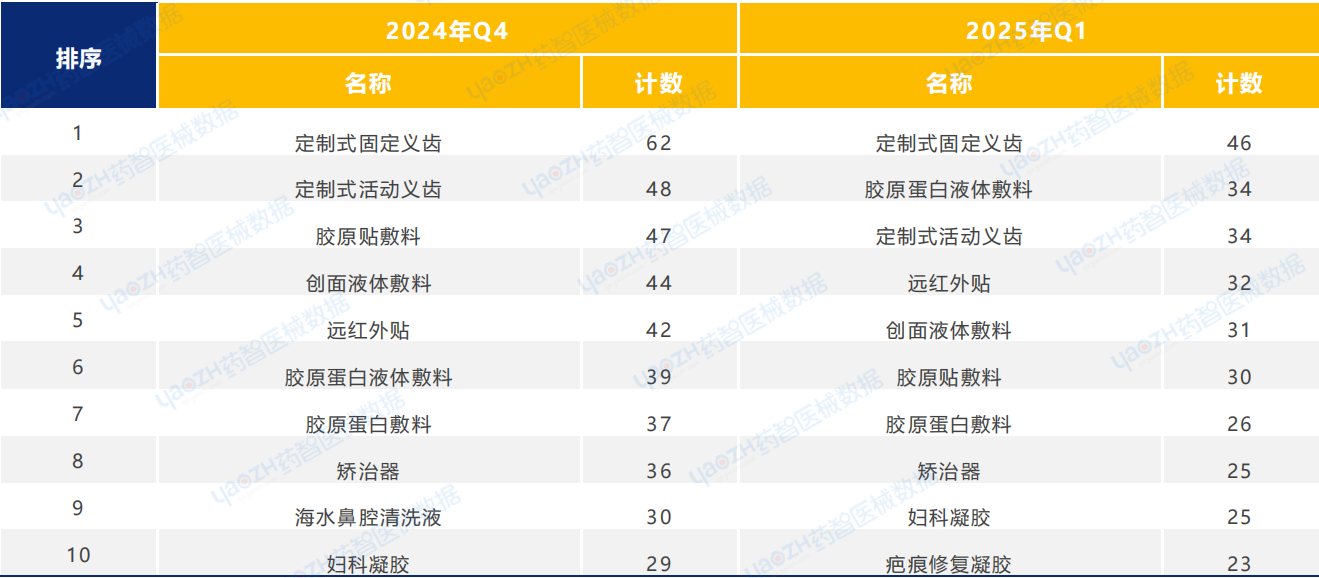
根據醫療器械產品的首次注冊數量中,排名前十的品類進行分析,相較于2024年Q4季度,2025年Q1首次注冊的醫療器械產品中,口腔科器械和敷料類產品的注冊數量位居前列。
從產品類型來看,在2025年Q1季度的新注冊醫療器械產品中,低值耗材(972件)、體外診斷試劑(860件)以及高值耗材(792件)的注冊數量排名前三。
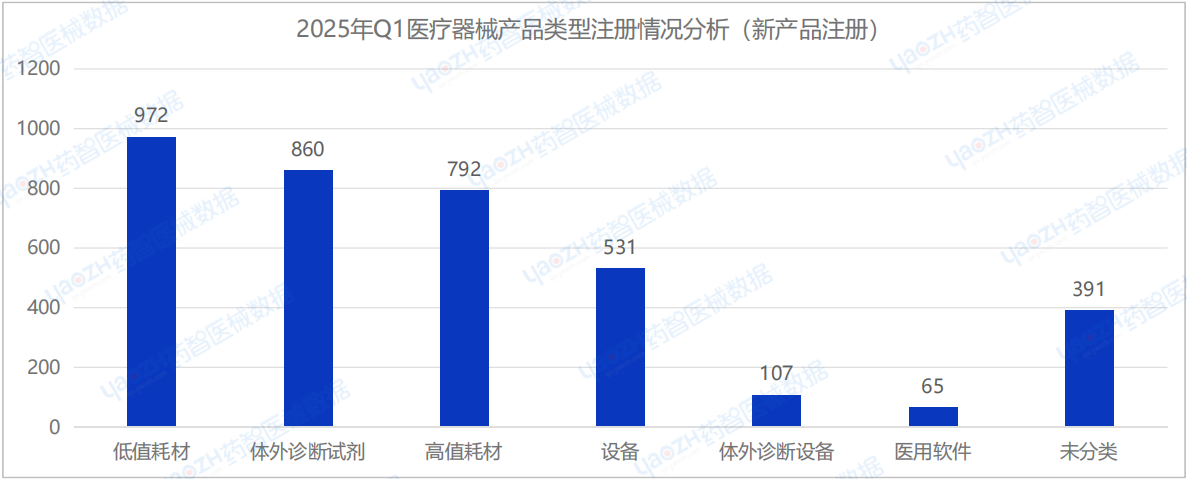
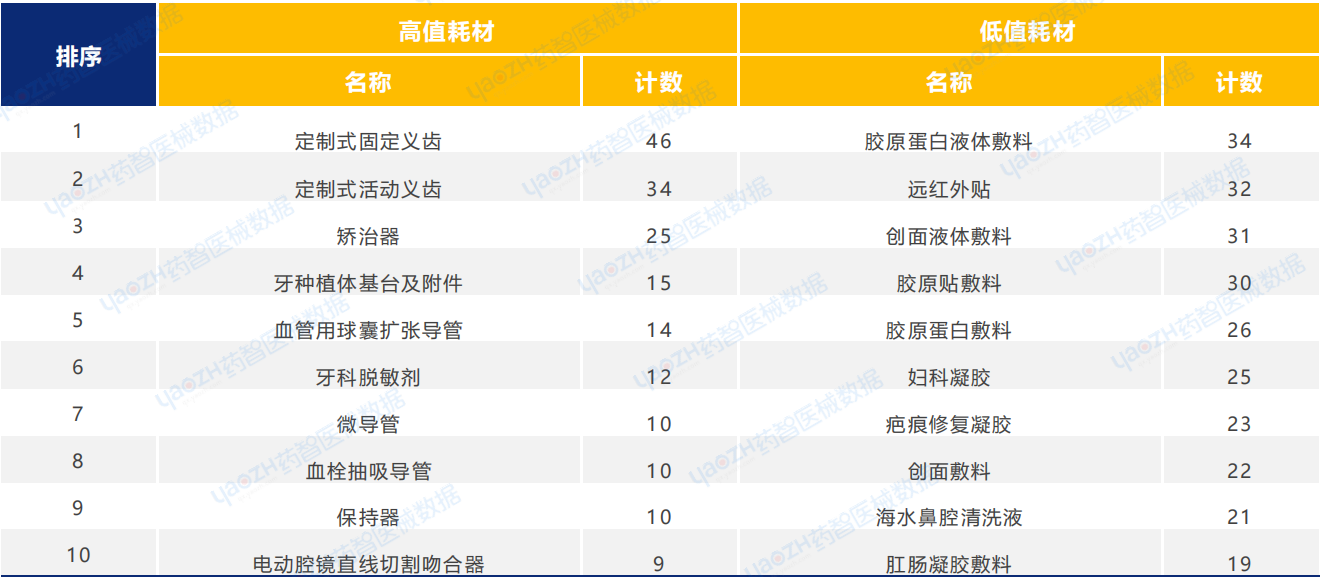
2025年Q1季度中,耗材類醫療器械新產品注冊共1764項,其中包括高值耗材792項,低值耗材972項。其中,高值耗材中義齒類醫療器械產品注冊數量較多,低值耗材中敷料類醫療器械產品注冊數量較多。
體外診斷類醫療器械新產品注冊共967項,包括體外診斷試劑860項,體外診斷設備107項。其中,鐵蛋白檢測試劑與全自動化學發光免疫分析儀注冊數量分別排名第一。
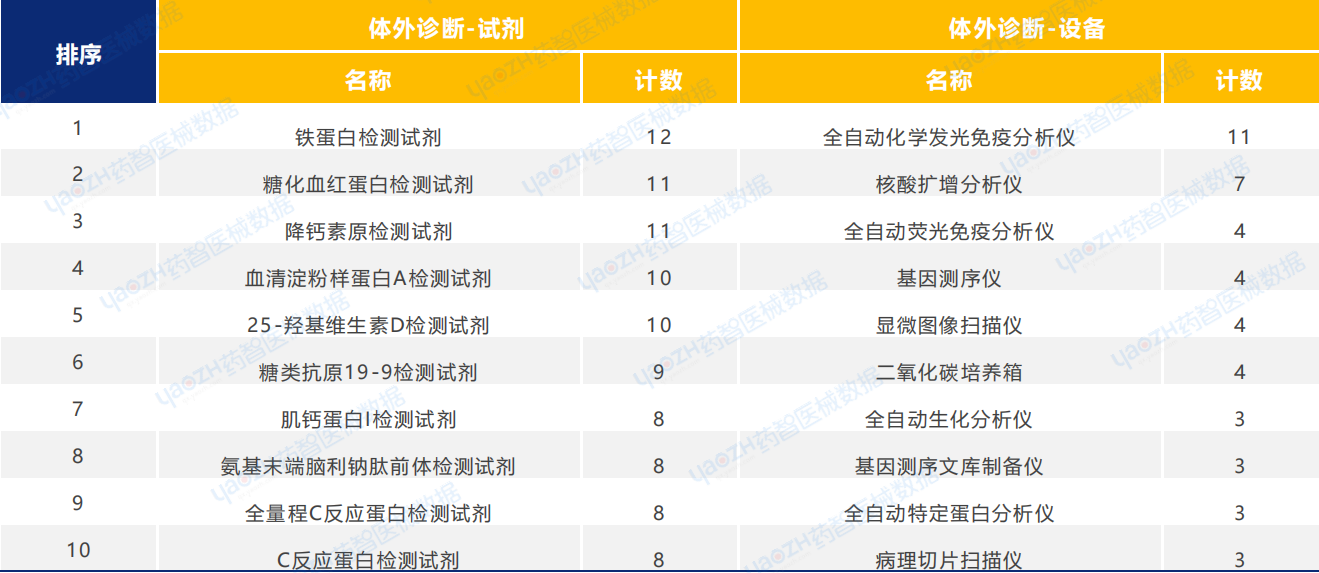
設備類醫療器械新產品注冊共531項。其中,內窺鏡圖像處理器的產品注冊數量排名第一。
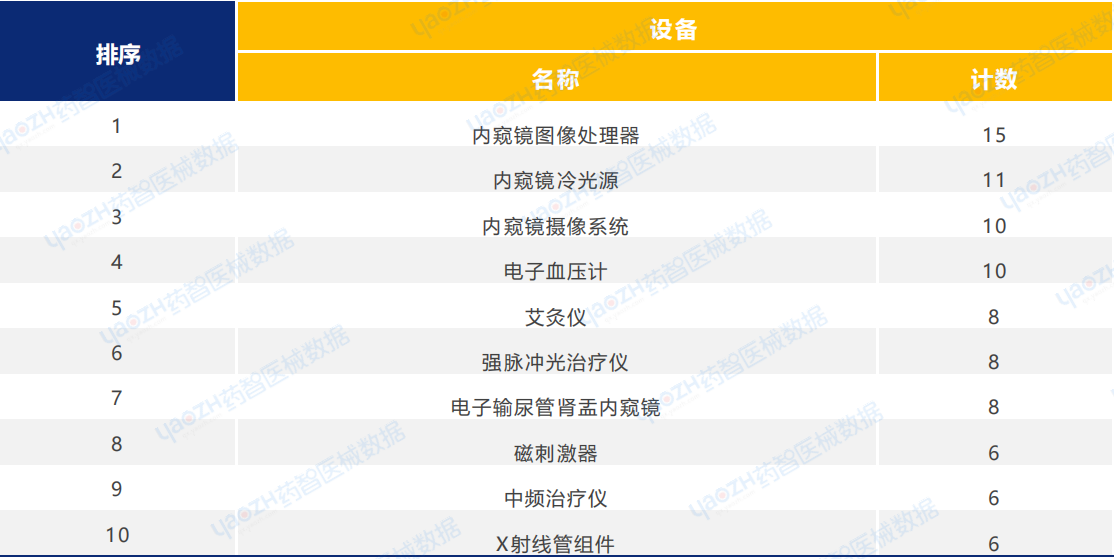
醫用軟件類醫療器械新產品注冊共65項。其中,醫學影像存儲與傳輸軟件產品注冊數量排名第一。
據《醫療器械監督管理條例》規定,第一類醫療器械采用產品備案管理方式。
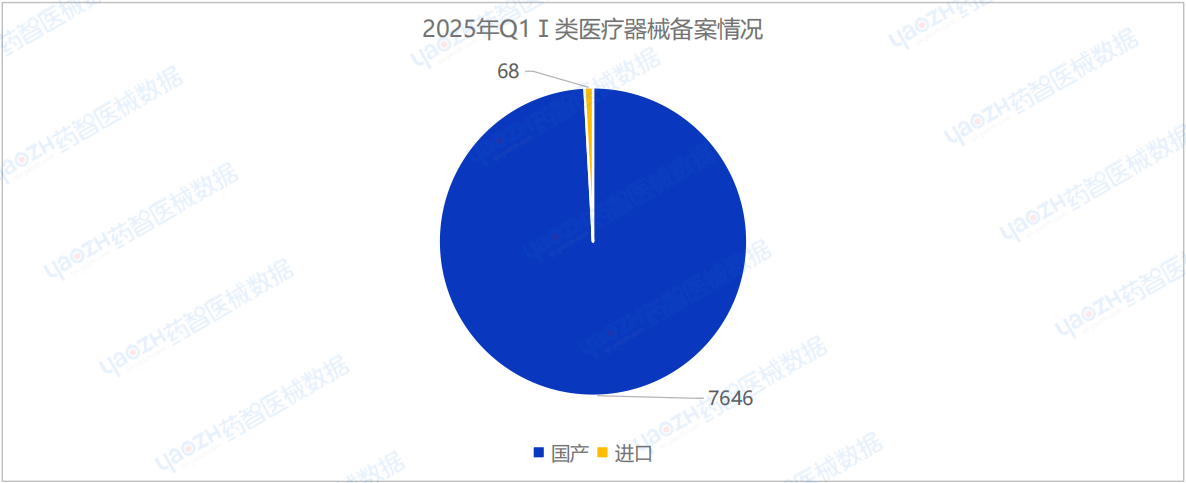
2025年Q1季度中,國產Ⅰ類醫療器械備案批準數量共7646項,環比減少27.6%。同時,進口Ⅰ類醫療器械備案批準數量共68項,環比減少35.2%。
02
新注冊產品來源地分析
從國產Ⅲ類醫療器械中新注冊產品的來源地分布來看,2025年Q1季度國內共有23個省市(不包括中國港澳臺)首次注冊Ⅲ類醫療器械,其中江蘇省新注冊的醫療器械數量最多,占國產Ⅲ類醫療器械新產品注冊數量的18.6%。
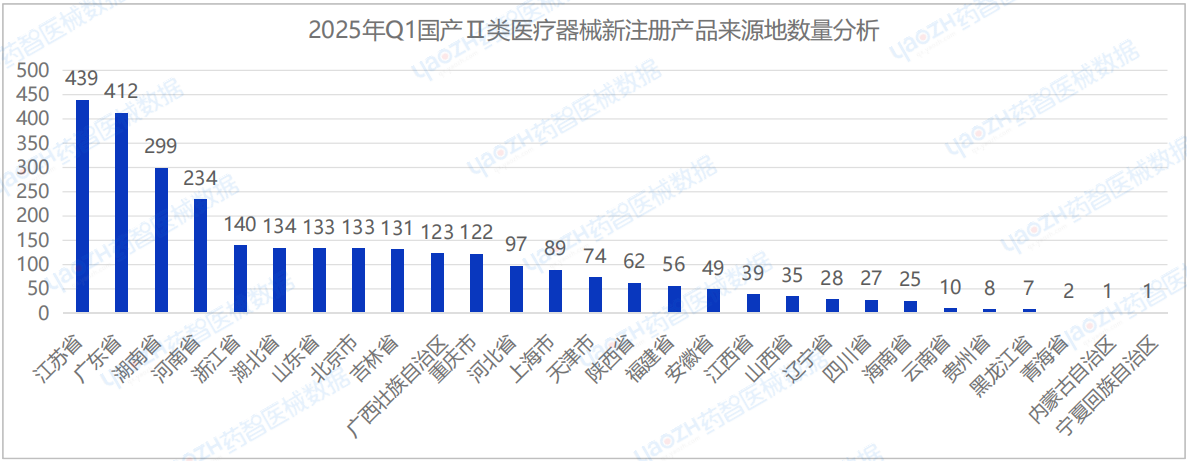
從國產Ⅱ類醫療器械中新注冊產品的來源地分布來看,2025年Q1季度國內共有28個省市(不包括中國港澳臺)首次注冊Ⅱ類醫療器械,其中江蘇省新注冊的醫療器械數量最多,占國產Ⅱ類醫療器械新產品注冊數量的15%。
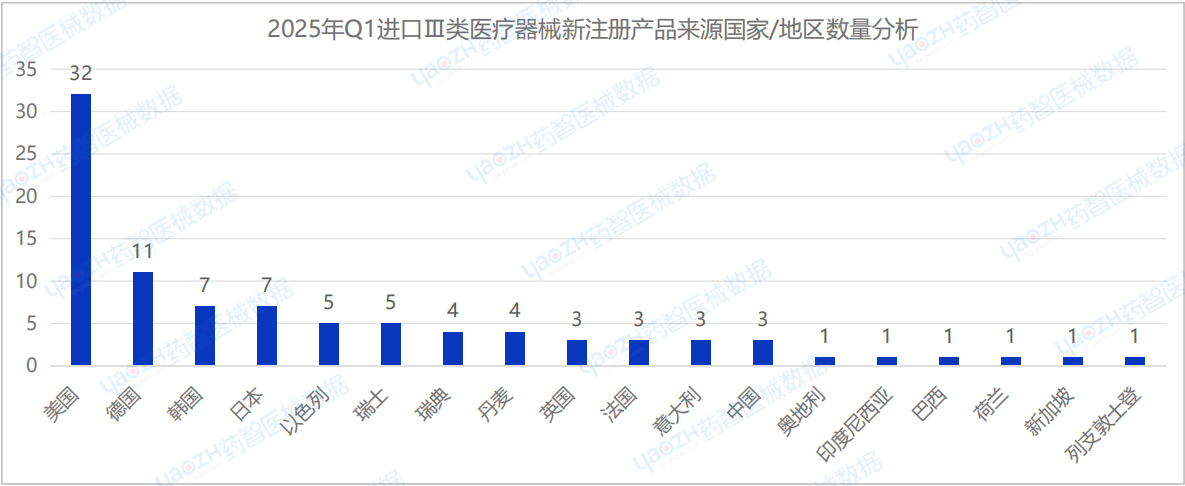
從進口Ⅲ類醫療器械中新注冊產品的來源國家/地區分布來看,2025年Q1季度共有18個國家/地區(包括中國港澳臺)首次注冊Ⅲ類醫療器械,其中美國新注冊的醫療器械數量最多,占進口Ⅲ類醫療器械新產品注冊數量的34.4%。
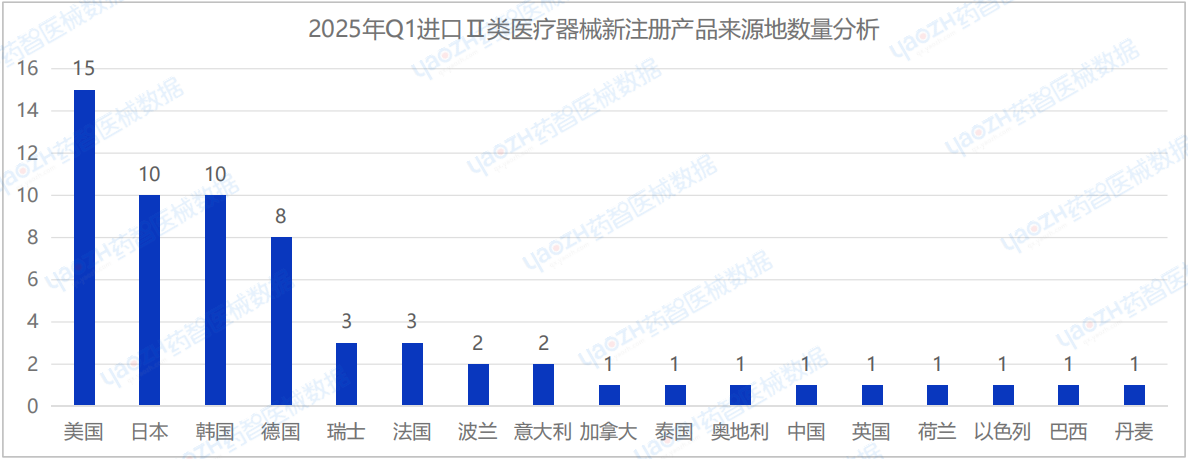
從進口Ⅱ類醫療器械中新注冊產品的來源國家/地區分布來看,2025年Q1季度共有17個國家/地區(包括中國港澳臺)首次注冊進口Ⅱ類醫療器械,其中美國新注冊的醫療器械數量最多,占進口Ⅱ類醫療器械新產品注冊數量的24.1%。
03
創新及優先審批
根據《創新醫療器械特別審批程序(試行)》,我國醫療器械創新審批是為了保障醫療器械的安全、有效,鼓勵醫療器械的研究與創新,促進醫療器械新技術的推廣和應用,推動醫療器械產業發展的特殊審批通道。
2025年Q1季度,在全國進入創新特別審批通道的注冊產品中,包括53項國產注冊產品,3項進口注冊產品。從產品類別來看:包括46項器械產品,10項試劑產品。
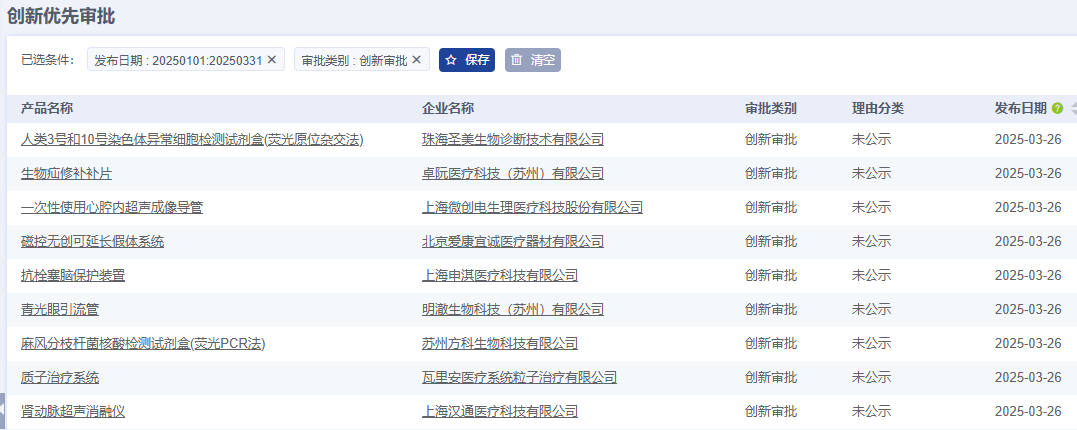
從分布地區來看,2025年Q1季度共有10個省市注冊國產創新審批醫療器械,其中江蘇省注冊數量排名第一,為16項。
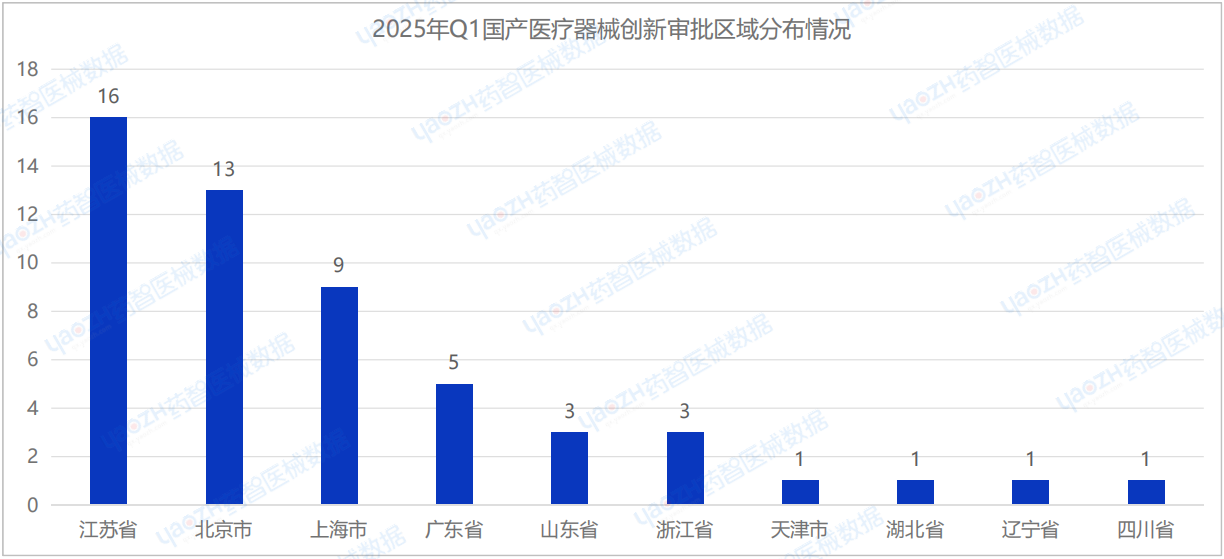
此外,在2025年Q1季度中,共有2個國家注冊進口創新審批醫療器械,其中美國2項,德國1項。
2016年10月25日,國家藥監局發布《醫療器械優先審批程序》,于2017年1月1日起施行。根據《醫療器械優先審批程序》,對下列醫療器械實施優先審批:
-
一是診斷或治療罕見病、惡性腫瘤且具有明顯臨床優勢的醫療器械,診斷或治療老年人特有和多發疾病且尚無有效診斷或治療手段的醫療器械,專用于兒童且具有明顯臨床優勢的醫療器械;
-
二是列入國家科技重大專項或國家重點研發計劃的醫療器械。
此外,將根據各方面情況和意見,組織專家審查后,確定對“其他應當優先審批的醫療器械”予以優先審批。
2025年Q1季度,在全國進入優先審批程序的注冊產品中,包括12項國產注冊產品,6項進口注冊產品。從產品類別來看:包括8項器械產品,10項試劑產品。

注:以上僅為部分產品信息截圖,更多優先審批產品信息請前往藥智醫械數據-創新優先審評數據庫查看
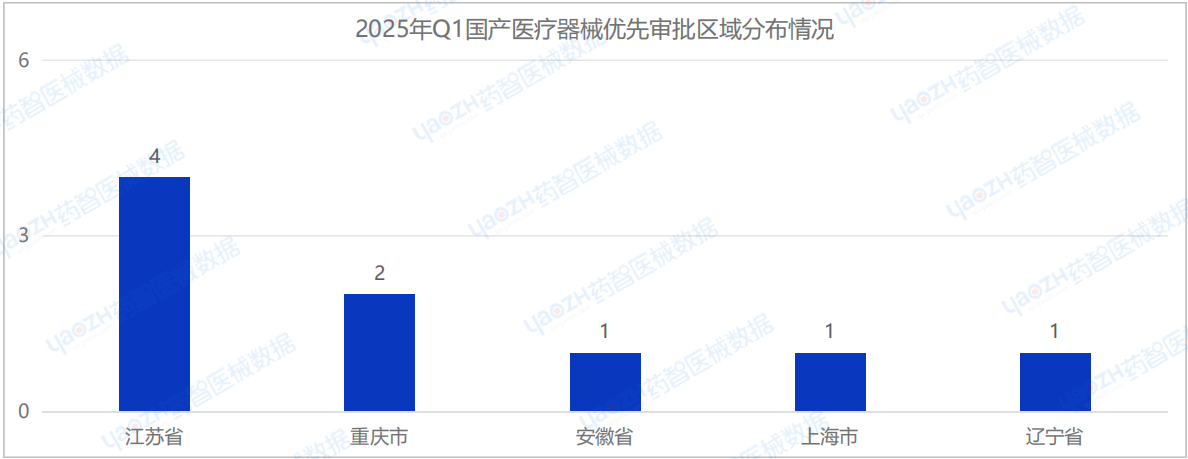
從分布地區來看,2025年Q1季度共有5個省市注冊醫療器械進入優先審批,其中江蘇省注冊數量排名第一,為4項。
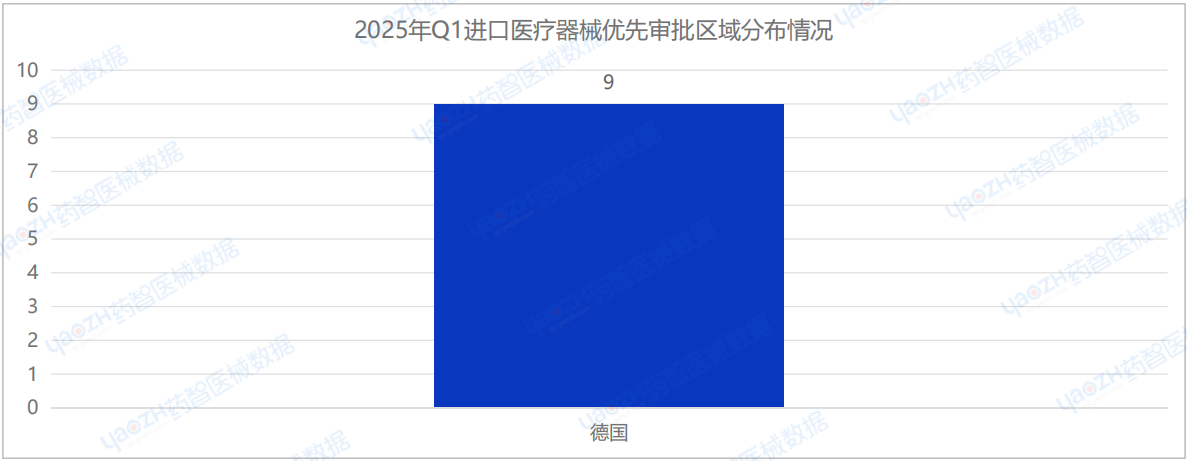
此外,在2025年Q1季度中,只有德國注冊進口創新審批醫療器械,共9項。
04
注冊企業分析
2025年Q1季度中,國內新注冊產品的醫療器械企業達1974家。在排行前十的企業中,廣州達泰生物工程技術有限公司新產品注冊數量排名第一、重慶新賽亞生物科技有限公司排名第二,鄭州安圖生物工程股份有限公司排名第三。排行前十的企業情況如下圖所示:
據藥智醫械數據—上市器械篩選系統顯示,廣州達泰生物工程技術有限公司在2025年Q1季度共完成了35項醫療器械新產品注冊,注冊產品數量排名第一,均為Ⅱ類體外診斷試劑產品。
注:以上僅為部分產品信息截圖,更多企業產品注冊信息請前往藥智醫械數據-上市器械篩選系統查看
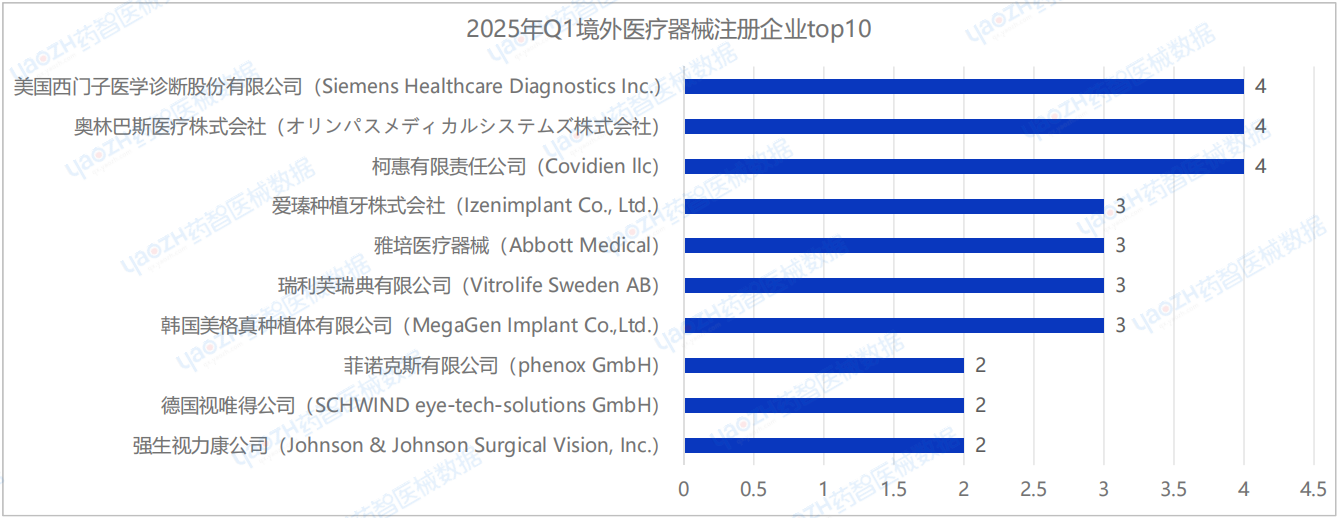
2025年Q1季度中,國內進口醫療器械新產品注冊企業達126家(包括中國港澳臺)。排行前十的企業中:美國西門子醫學診斷股份有限公司(Siemens Healthcare Diagnostics Inc.)、奧林巴斯醫療株式會社(オリンパスメディカルシステムズ株式會社)、柯惠有限責任公司(Covidien llc)的注冊數量排名并列第一,排行前十的企業情況如下圖所示。
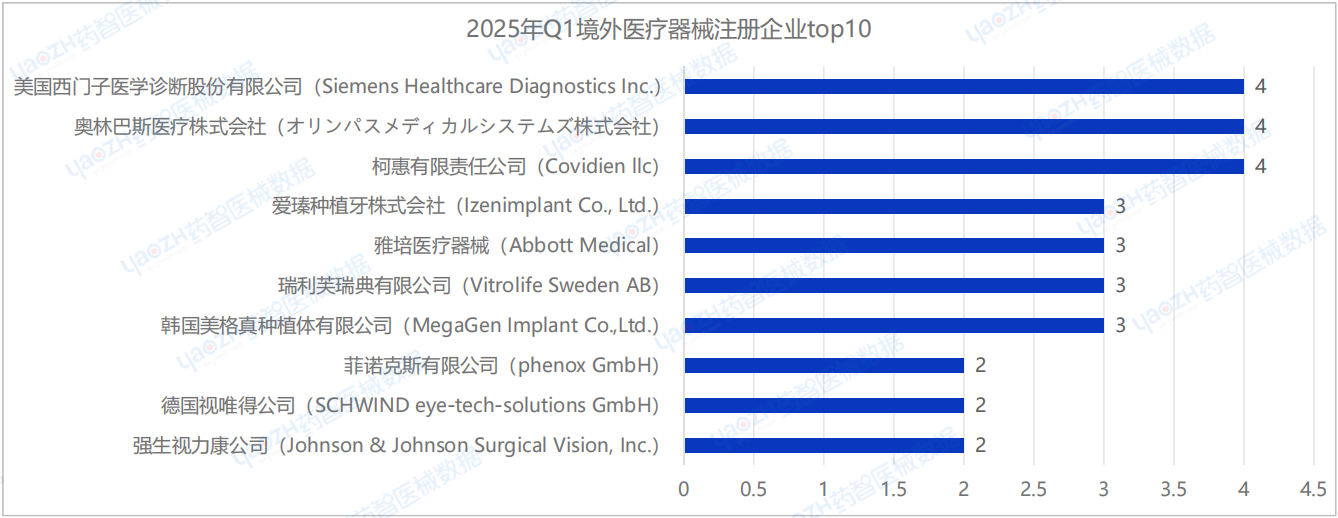
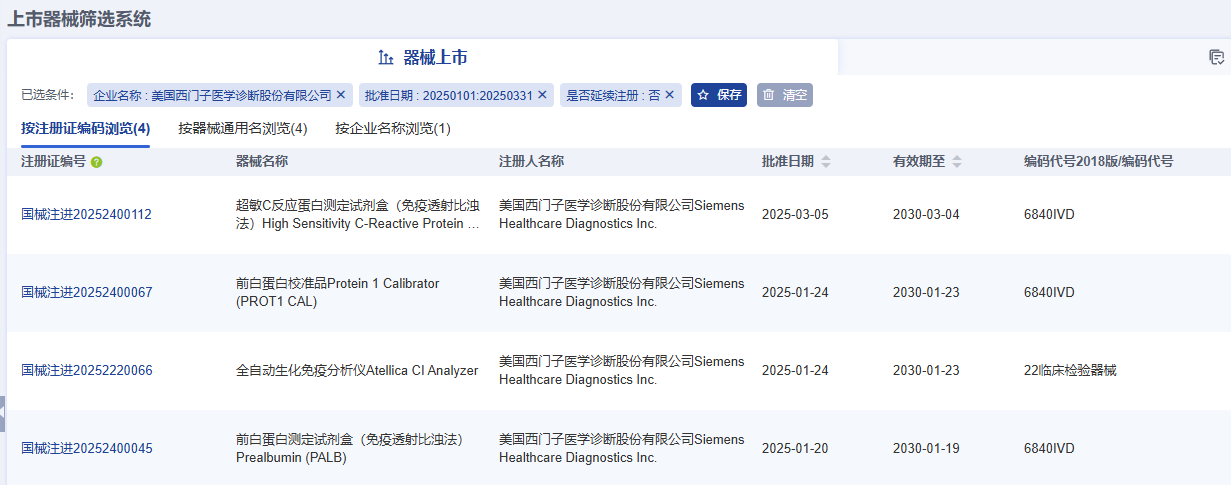
據藥智醫械數據—上市器械篩選系統顯示,2025年Q1季度美國西門子醫學診斷股份有限公司(Siemens Healthcare Diagnostics Inc.)共完成了4項醫療器械新產品注冊,注冊產品數量排名第一,其中包括3項Ⅱ類試劑產品,1項Ⅱ類器械產品。
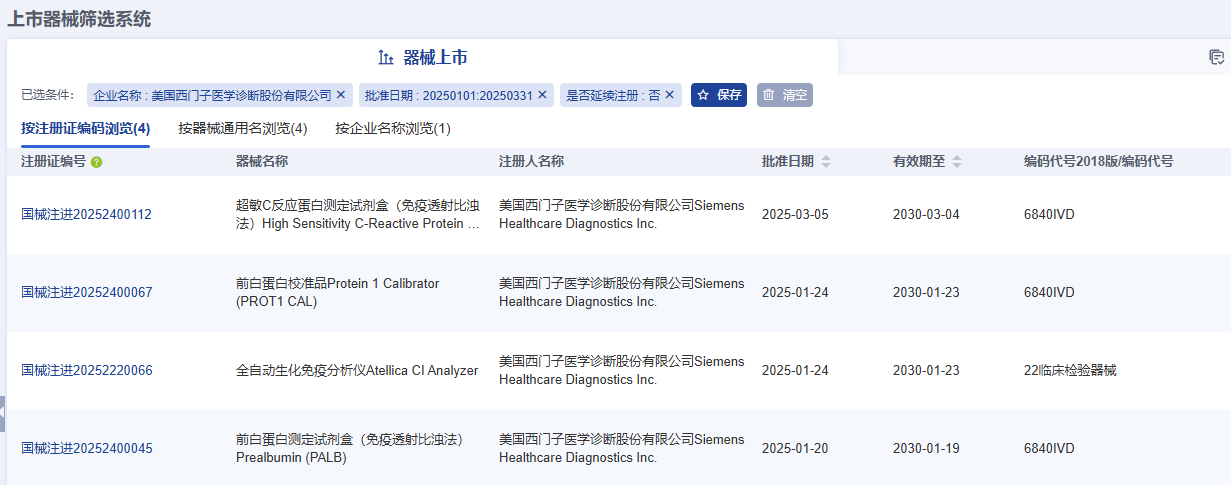
注:以上僅為部分產品信息截圖,更多企業產品注冊信息請前往藥智醫械數據-上市器械篩選系統查看
奧林巴斯醫療株式會社(オリンパスメディカルシステムズ株式會社)共完成了4項醫療器械新產品注冊,注冊產品數量排名第一,其中包括2項Ⅱ類器械產品,2項Ⅲ類器械產品。
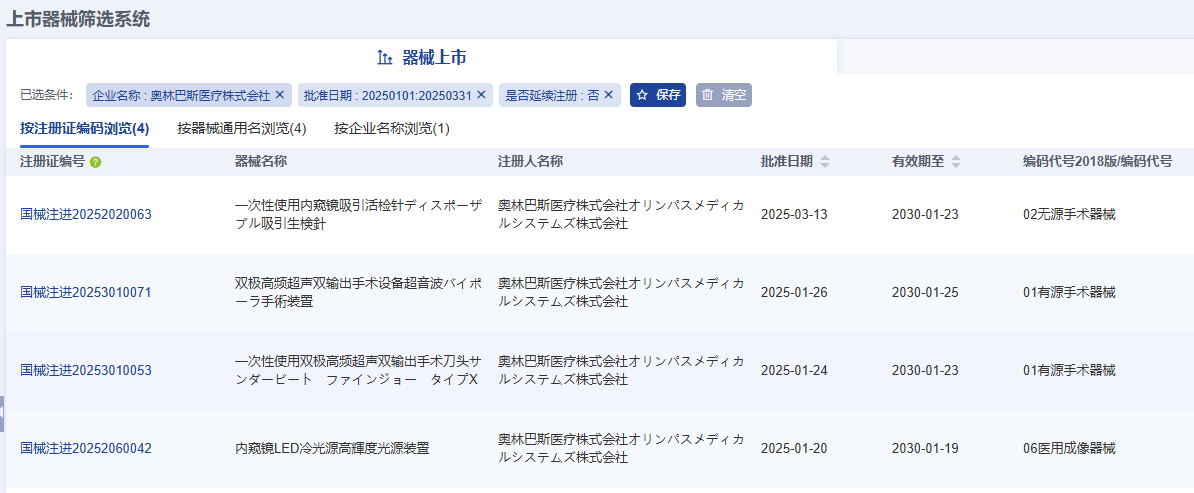
注:以上僅為部分產品信息截圖,更多企業產品注冊信息請前往藥智醫械數據-上市器械篩選系統查看
柯惠有限責任公司(Covidien llc)共完成了4項醫療器械新產品注冊,注冊產品數量排名第一,其中包括1項Ⅱ類器械產品,3項Ⅲ類器械產品。
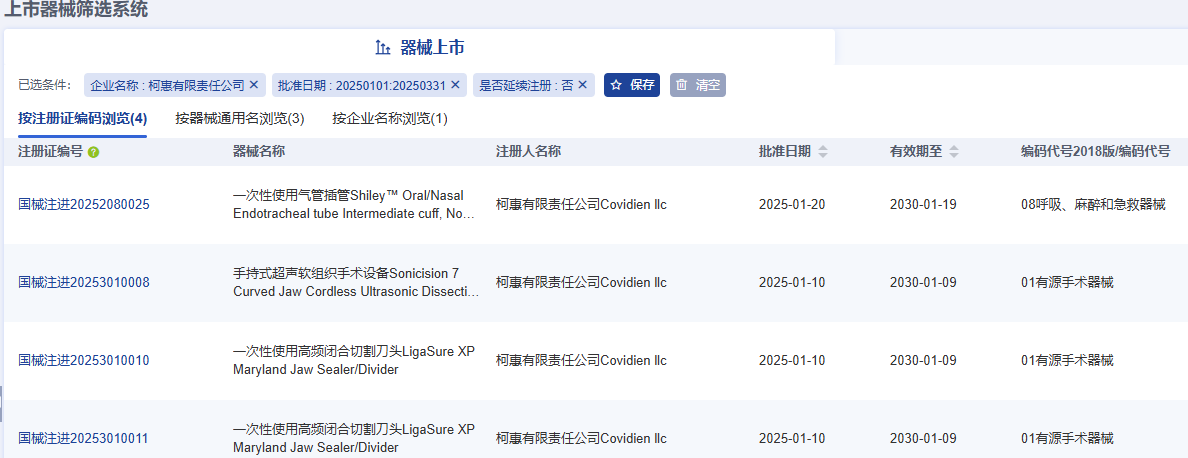
【來源:藥智醫械】